PRÁCTICAS DE LABORATORIO
PRÁCTICA 1. Determinación del pH de tierras y soluciones.
Determinación de pH de soluciones preparadas
Para ello, con ayuda de una pipeta, se tomaron 5 ml de cada solución (previamente vertidas en vasos de precipitado diferentes) y se introdujeron en distintos tubos de ensayo. Una vez realizado, con ayuda de las tiras de pH, se determinó el pH de cada una de las sustancias.
Determinación de pH de tierras del invernadero
En primer lugar, realizamos la medición del pH de diferentes soluciones líquidas (alcohol, amoniaco, agua, etc.) para conocer la sistemática y el protocolo que se tenía que realizar.
En segundo lugar, realizamos la medición del pH de la tierra del invernadero (tomando la muestra en diferentes puntos de este). Para ello, tapizamos la tierra muestreada con ayuda de un tamiz y pesamos 20 gramos de dicha tierra. Seguidamente, con ayuda de una probeta, medimos 50 ml de agua destilada, la vertemos en un vaso de precipitados y disolvemos la arena pesada agitando con una varilla durante 2 minutos.
Dejamos reposar la solución durante 15 minutos y tomamos 1 ml con ayuda de la pipeta (retirando el sobrenadante) y lo echamos cuidadosamente encima de la tira de pH para obtener el resultado.
Para ello, con ayuda de una pipeta, se tomaron 5 ml de cada solución (previamente vertidas en vasos de precipitado diferentes) y se introdujeron en distintos tubos de ensayo. Una vez realizado, con ayuda de las tiras de pH, se determinó el pH de cada una de las sustancias.
En primer lugar, realizamos la medición del pH de diferentes soluciones líquidas (alcohol, amoniaco, agua, etc.) para conocer la sistemática y el protocolo que se tenía que realizar.
En segundo lugar, realizamos la medición del pH de la tierra del invernadero (tomando la muestra en diferentes puntos de este). Para ello, tapizamos la tierra muestreada con ayuda de un tamiz y pesamos 20 gramos de dicha tierra. Seguidamente, con ayuda de una probeta, medimos 50 ml de agua destilada, la vertemos en un vaso de precipitados y disolvemos la arena pesada agitando con una varilla durante 2 minutos.
Dejamos reposar la solución durante 15 minutos y tomamos 1 ml con ayuda de la pipeta (retirando el sobrenadante) y lo echamos cuidadosamente encima de la tira de pH para obtener el resultado.
PRÁCTICA 2. Extracción de clorofilas mediante cromatografía.Los
cloroplastos deben su color verde a un pigmento denominado clorofila. Sin
embargo, lo que en realidad existe en los cloroplastos es una mezcla de
pigmentos representados principalmente por dos tipos de clorofila (clorofila a
y clorofila b), por β caroteno y por xantofila. Todas estas sustancias
presentan un grado diferente de solubilidad, lo cual permite su separación
cuando una solución de la misma asciende por capilaridad por una tira de papel
poroso (papel de filtro), ya que las más solubles se desplazarán a mayor
velocidad, pues acompañarán fácilmente al disolvente a medida que éste va
ascendiendo.
De
esta forma, al cabo de cierto tiempo, a lo largo del papel de filtro se irán
situando los distintos pigmentos en forma de bandas coloreadas, tanto más
desplazadas cuanto más solubles sean los pigmentos a que pertenecen y tanto más
anchas cuanto mayor sea la abundancia de estos en la mezcla.
Los
cloroplastos poseen una mezcla de pigmentos con diferentes colores: clorofila-a
(verde intenso), clorofila-b (verde), carotenos (amarillo) y xantofilas
(amarillo anaranjado) en diferentes proporciones.
MÉTODO
Extracción
del pigmento
Colocar en un
mortero trozos de hojas lavadas (quitando las nerviaciones más gruesas) junto
con 50 ml de alcohol de 96º. Triturar sin golpear hasta que el líquido adquiera
una coloración verde intensa.
Filtrar,
recogiendo el filtrado en un matraz. Se obtiene así una solución en alcohol de
pigmentos.
Separación de los pigmentos
La solución
antes obtenida se vierte sobre una placa de Petri. Se coloca un papel de filtro
doblado en ángulo sobre la solución (de forma que se quede de pie verticalmente)
y se deja en reposo el tiempo necesario.
PRÁCTICA 3. Visualización de diferentes muestras histológicas vegetales.
Los
cloroplastos deben su color verde a un pigmento denominado clorofila. Sin
embargo, lo que en realidad existe en los cloroplastos es una mezcla de
pigmentos representados principalmente por dos tipos de clorofila (clorofila a
y clorofila b), por β caroteno y por xantofila. Todas estas sustancias
presentan un grado diferente de solubilidad, lo cual permite su separación
cuando una solución de la misma asciende por capilaridad por una tira de papel
poroso (papel de filtro), ya que las más solubles se desplazarán a mayor
velocidad, pues acompañarán fácilmente al disolvente a medida que éste va
ascendiendo.
De
esta forma, al cabo de cierto tiempo, a lo largo del papel de filtro se irán
situando los distintos pigmentos en forma de bandas coloreadas, tanto más
desplazadas cuanto más solubles sean los pigmentos a que pertenecen y tanto más
anchas cuanto mayor sea la abundancia de estos en la mezcla.
Los
cloroplastos poseen una mezcla de pigmentos con diferentes colores: clorofila-a
(verde intenso), clorofila-b (verde), carotenos (amarillo) y xantofilas
(amarillo anaranjado) en diferentes proporciones.
MÉTODO
Extracción
del pigmento
Colocar en un mortero trozos de hojas lavadas (quitando las nerviaciones más gruesas) junto con 50 ml de alcohol de 96º. Triturar sin golpear hasta que el líquido adquiera una coloración verde intensa.
Filtrar, recogiendo el filtrado en un matraz. Se obtiene así una solución en alcohol de pigmentos.
La solución
antes obtenida se vierte sobre una placa de Petri. Se coloca un papel de filtro
doblado en ángulo sobre la solución (de forma que se quede de pie verticalmente)
y se deja en reposo el tiempo necesario.
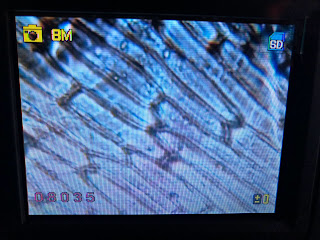
VISUALIZACIÓN DE EPIDERMIS DE CEBOLLA
1. Preparamos la mesa de trabajo con papel de filtro y los materiales necesarios para realizar la práctica:
- Microscopio
2. Cogemos un gajo de cebolla y retiramos la epidermis con cuidado y la depositamos sobre un porta.
3. Echamos una gota de azul de metileno sobre la preparación y dejamos secar.
4. Visualizamos al microscopio siguiendo el procedimiento de enfoque explicado en clase, sin utilizar el objetivo de inmersión.









Comentarios
Publicar un comentario